NOMENCLATURA
lunes, 25 de agosto de 2014
sábado, 23 de agosto de 2014
CLASES DE NOMENCLATURA
ACTUALMENTE SE TIENEN:
NOMENCLATURA TRADICIONAL
Se designa a la valencia del elemento de nombre especifico con una serie de prefijos y sufijos.
COMO NOMBRAR?


NOMENCLATURA TRADICIONAL
Se designa a la valencia del elemento de nombre especifico con una serie de prefijos y sufijos.
COMO NOMBRAR?
- estado de oxidación nombre de elemento
- estados de oxidación OSO ICO
ICO : mayor estado de oxidación
3. estados de oxidación
HIPO Y OSO: menor menor
OSO : menor
ICO: mayor

EJEMPLOS
:Cu2O = oxido cubroso
CuO = oxido cubrico
As2O3 = oxido de arsenico
As2O5 = oxido de arsenoso
Ag2O = oxido de plata

CLASES DE NOMENCLATURA
ACTUALMENTE SE TIENEN:
NOMENCLATURA DE STOCK
Utiliza para designar los compuestos escribiendo al final del nombre con números romanos incluidos en paracentesis indicamos el estado de oxidación de elemento; esta nos indica el numero de electrones que un átomo utiliza cuando realiza un enlace químico.
COMO NOMBRAR?
Bajo este sistema los compuestos se nombran de la siguiente manera
nombre genérico+ de +nombre del elemento especifico + numero de valencia.

EJEMPLOS:
I2O = oxido de iodo ( I )
K2O = oxido de potasio ( I )
OCo = oxido de cobre ( II )
As2O3 = oxido de arsenico ( III )
CuO = oxido de cobre ( III )
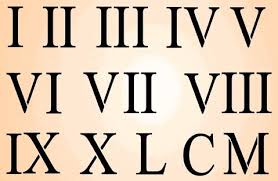
NOMENCLATURA DE STOCK
Utiliza para designar los compuestos escribiendo al final del nombre con números romanos incluidos en paracentesis indicamos el estado de oxidación de elemento; esta nos indica el numero de electrones que un átomo utiliza cuando realiza un enlace químico.
COMO NOMBRAR?
Bajo este sistema los compuestos se nombran de la siguiente manera
nombre genérico+ de +nombre del elemento especifico + numero de valencia.
EJEMPLOS:
I2O = oxido de iodo ( I )
K2O = oxido de potasio ( I )
OCo = oxido de cobre ( II )
As2O3 = oxido de arsenico ( III )
CuO = oxido de cobre ( III )
CLASES DE NOMENCLATURA
CLASES DE NOMENCLATURA PARA COMPUESTOS INORGÁNICOS :
ACTUALMENTE SE TIENEN
NOMENCLATURA SISTEMÁTICA
Nombra sustancias utilizando prefijos numéricos griegos que indican la automicidad de los elementos de la molécula. así se dice el numero de elementos que están presentes; en la formula química es la proporción de cada elemento. Por esta razón la automicidad es considerada como el numero de átomos de un elemento en una sola molécula.
COMO NOMBRAR?
La forma de nombrar los compuestos en este sistema es:
prefijo-nombre genérico+ prefijo-nombre especifico
generalmente solo se utiliza el prefijo HEPTA
EJEMPLOS:

ACTUALMENTE SE TIENEN
NOMENCLATURA SISTEMÁTICA
Nombra sustancias utilizando prefijos numéricos griegos que indican la automicidad de los elementos de la molécula. así se dice el numero de elementos que están presentes; en la formula química es la proporción de cada elemento. Por esta razón la automicidad es considerada como el numero de átomos de un elemento en una sola molécula.
COMO NOMBRAR?
La forma de nombrar los compuestos en este sistema es:
prefijo-nombre genérico+ prefijo-nombre especifico
generalmente solo se utiliza el prefijo HEPTA
| Prefijos griegos | numero de átomos |
| mono- | 1 |
| di- | 2 |
| tri- | 3 |
| tetra- | 4 |
| penta- | 5 |
| hexa- | 6 |
| hepta- | 7 |
| oct- | 8 |
| non- nona- eneá- | 9 |
| deca- | 10 |
CrBr3 = tribromuro de cromo
CO = monóxido de carbono
CuO = monoxido de monocobre
Co2oO= trioxido de dicobre
As2O3= trioxido de diarsenico

NOMENCLATURA
NOMENCLATURA: proviene de la palabra latín nomenclatūra son reglas o normas utilizadas para nombrar e identificar elementos y compuestos químicos.
su máxima autoridad la unión internacional de química pura y aplicada se encarga de establecer sus reglas correspondientes; estas a su vez existen dos muy importantes una es para los compuestos inorgánicos que pueden conocerse como el libro rojo, la segunda es asignada para los compuestos orgánicos.
Compuestos orgánicos: se designa a los compuestos que contienen carbono y se enlazan generalmente con hidrógeno, oxigeno, nitrógeno azufre y algunos halogenos.
Compuestos inorgánicos: se designa según su función química y por el numero de elementos químicos que los forman, con reglas distintas para cada grupo. las principales funciones químicas son óxidos, bases, ácidos y sales.
Suscribirse a:
Entradas (Atom)